مواد باتریهای لیتیوم-یون
مواد کاتدی بلوری
مواد کاتدی دارای عناصر معمولی شامل نیکل،گنز،کبالت،منظوره و آهن میباشند. هر کدام از این مواد دارای ساختار کریستالی منحصر به فرد در سطوح اتمی هستند که بر عملکرد آنها تأثیر زیادی دارند. مواد کاتدی در سه دسته ساختاری اسپینل، لایههای و اولوین تقسیمبندی میشوند (شکل ۱). مواد کاتدی ساختارشان دارای لیتیوم باشد (برای شروع عملیات عملیاتی) در حالیکه مواد آن اینطور است.
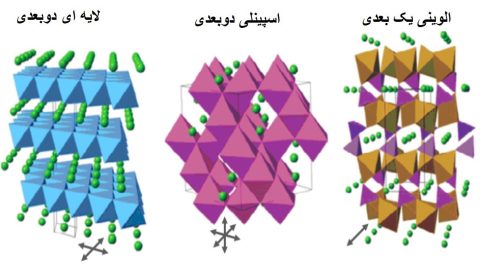
شکل1: ساختار بلوری مواد کاتدی
کاتدهای لایه ای (دو بعدی)
اولین و متداولترین گروه کاتدها، که مادهای کاتدی LCO (لیتیوم کبالت اسید) هم جز آن است، دارای ساختار کریستالی لایههای میباشند، که میتوان یونهای لیتیوم را به صورت برگشتپذیر به شکل قفسهای در خود جا داد. از آنجایی که یونهای لیتیوم فقط میتوانند در جهت حرکت قفسهها، این مواد به عنوان مواد بعدی دستهبندی شوند. مواد کاتدی LCO که دارای ساختار لایههای هستند، ابتدا در سال 1980 توسط جان گودنوف به عنوان یک بلور ساختاری پایدار، که میتوان به طور مجدد پذیرفت یونهای لیتیوم را با کارایی بالا در خود جای دهنده، کشف کرد. قابل توجه است که این ماده کاتدی هنوز هم از گوشی های تلفن همراه و مصرف کننده های الکترونیکی استفاده می شود. این مادهی کاتدی به راحتی، از آستانهی لباس تجاوز نمیکند. این موضوع به این دلیل است که LCO با وجود داشتن پایداری ساختاری خوب، پایداری حرارتی ضعیفی دارد. در دماهای بالاتر از C˚150، مادهای LCO به صورت گرمازا شروع به شکسته شدن میکند. با شکسته شدن LCO موجود در ساختار آزاد میشود که باعث افزایش شدت آتش سوزی احتمالی میشود. بعدها تشخیص داده شد، که به جای کبالت خالص، میتوانیم فلزات مانند نیکل و منگنز را برای افزایش و بهبود ایمنی با کبالت ترکیب کنیم. این مواد کاتدی را به اختصار NCM با نسبتهای استوکیومتری متفاوت هر جز شناخته شدهاند. نسبت هر کدام از عناصر موجود در مادهای NCM بزرگی بر روی چگالی انرژی، ایمنی و قیمت این مادهای دارد. به همین دلیل به بررسی این موضوع پرداخت.
اولین مادهای کاتدی NCM که ارائه شد، شامل نسبتهای یکسانی از عناصر نیکل، منگنز و کبالت بود که آن را NCM111 مینامند (یا NCM333 به معنای 30% برای هر عنصر). این ترکیب باعث افزایش پایداری حرارتی تا دمای C˚200 میشود در حالیکه چگالی انرژی ثابت میماند. به طور کلی، کاهش میزان عنصر کبالت در مواد کاتدی مطلوب است. چون این عنصر سمی و گران است. عظیمی از کبالت استفاده در دنیا، در کشور کنگو توسط کودکان کار در شرایط سختی میشود. دلیل استفاده از کبالت در مواد کاتدی، استفاده از این عنصر در ایجاد ساختاری پایدار در مواد کاتدی، در طول چرخه مصرف باتری است. کنار گذاشتن کلی کبالت اشتباه است. به طور کلی، افزایش مقدار نیکل در مواد کاتدی، برای افزایش میزان میزان و چگالی انرژی راه حل مطلوبی است. افزایش مقدار نیکل، علاوه بر مثبتی که دارد، معایبی مانند کاهش پایداری ساختاری و تأثیر بر عمر چرخهای را نیز دارد. علاوه بر این، افزایش مقدار نیکل، احتمال بازآرایی گرماز، در حین آزاد شدن افزایش میدهد که برای انفجار خوب نیست. افزایش مقدار نیکل باعث میشود که مادهای حاصل شود، هوا را به مقدار زیادی جذب کند، که این موضوع باعث میشود که دستساز نشود غیر قابل برگشت میشود. بنابراین، این پودرها از لحظهای تولید میکنند تا زمانی که در داخل باتری به کار میروند در شرایط فوقالعاده خشک نگه داشته میشوند. منگنز به طور کلی به عنوان یک پایدار کننده خوب برای مواد کاتدی است. منگنز ارزان و غیر سمی است اما قابل فهم به آن حلال در الکترولیت دارد، انحلال منگنز در الکترولیت باعث می شود افت سریع توان می شود.
از آن جا که چگالی انرژی و هزینههای تولید مواد دیسکی است، از بقیه موارد بیشتر است، راه حل افزایش میزان نیکل، کاهش کبالت و تنظیم تنظیم با منگنز است. به همین دلیل، فقط در دهههای گذشته، ما شاهد انتقال از NCM333به NCM811 هستیم که حاوی قریباً 80% نیکل، 10% کبالت و 10% منگنز می باشد.
NCM811 دارای ویژگی معمولی 40% بیشتر از LCO میباشد. همچنین به دلیل میزان کبالت کمتر در NCM811، دارای قیمت ارزانتر نسبت به LCO است در حالی که پایداری گرمایی این دو مادهی کاتدی تقریباً برابر است. پکهای باتری خودروهای الکتریکی که با این مادهای ساخته میشوند باید با دقت مدیریت و طراحی شوند تا هرگز از آستانهایکاتی تجاوز نکنند. همچنین برای اعمال هزاران چرخه روی این باتریها توسعه قابل توجه الکترولیت مورد نیاز است.
افزایش بیشتر میزان نیکل با درصدهای نیکل بیش از 90% و کبالت کمتر از 3% قبلاً داده شده است. با این وجود کاهش از اندازهای کبالت برای یک کبالت بدون کبالت مهم است و یک خطر برای عمر چرخهای باتری نیز میباشد. به موازات بهبود NCM، تجهیزات (Al) می میها به عنوان دوپانت استفاده شوند، این مادهی کاتدی تحت عنوان NCA شناخته میشود. این استوکیومتریها با ترکیب و مواد مختلف میتوانند به عنوان دوپانت برای پایدار کردن سیستم، در داخل آن قرار بگیرند. کاتدهای NCA در بسیاری از سلولهای استوانهای، سلولهایی که توسط تسلا استفاده میشوند، مورد استفاده قرار میگیرند.
کاتدهای اسپانیایی (سه بعدی)
در حالیکه کاتدهای با ساختار لایههای، دو درجه آزادی به یون لیتیوم میدهند، کاتدهای با ساختار اسپینل، دارای 3 درجه آزادی برای لیتیوم میباشند. در نتیجه این ساختارها میتوانند جامد را خیلی سریعتر داشته باشند. تنها مادهی کاتدیینلی که تجاری شده است، لیتیوم منگنز اکسید اسپری (LMO) میباشد. مواردی که در بخشهای قبل گفته شد، منگنز به دلیل حل شدن در الکترولیت ((بدنام)) است، که به صورت فلز منگنز با ساختار دندریتی روی آند رسوب میکند (مانند یونهای مسبب بعد از اضافه کردن دشارژ) که باعث میشود به سرعت سریعتر و سریعتر شوند. اتصال کوتاه می شود. به خاطرکات موضوع تشکیل دندریت توسط منگنز، تعداد کمی از باتریها از LMO استفاده میشود.
کاتدهای الوینی (یک بعدی)
سومین دستهای مواد کاتدی دارای ساختار الوینی میباشند، که در ساختار خود دارای تونلهای یک بُعدی برای حرکت یونهای لیتیوم هستند. این مواد به طور کلی دارای سرعتپذیری پایینی هستند. با این حال برای حل کردن تقریبی این موضوع میتوانم ذرات ماده فعال را بسیار کوچک (نانوذرات) کرد. در این مسیر پیمایش یون لیتیوم در داخل ساختار کاهش مییابد. تنها مادهای کاتدی با ساختار الوین که تجاری شده است، لیتیوم آهن فسفات (LFP) میباشد. چند نکته مهم در مورد LFP این است که غیر سمی است، با پیشماده هایی که به اندازه کافی موجود می شود، از نظر ساختاری و حرارتی پایدار است و همچنین بازیافت آن بسیار ساده است. اما مادهای کاتدی LFP دارای معایبی مانند کوچک و ولتاژ الکتروشیمیایی پایین است که این موضوع به آسیب انرژی چگالی میرساند. این معایب تا چند سال پیش به عنوان یک طلسم مرگبار برای کاربرد LFP در خودروهای الکتریکی بود. اما با توجه به، افزایش برای خودروهای الکتریکی ارزان قیمت و همچنین خودروهایی که در مسیرهای درون شهری تردد دارند، LFP یک بازگشت موفقیت آمیز را رقم زد. این مادهی کاتدی در حال حاضر برای ورژنهای قدیمی خودروهای الکتریکی استفاده میشوند.
علاوه بر این، از آنجایی که کاتدهای LFP به طور قابل توجهی از سایر مواد شیمیایی قابل توجه هستند، تولیدکنندگان متوجه شدند و میتوانند به ساخت سلولهای غول پیکر (بسیار بزرگتر از سلولهایی که بر پایه NCM ساخته میشوند) بسازند. این نکته، هزینه های مربوط به مراحل پک و بسته بندی را کاهش می دهد. در حالی که باتریهای مرسوم الکتریکی، از سلولهای خودروهایی که داخل ماژولها پک میشوند، سپس در ردیفهایی قرار میگیرند که هم میشوند و هم در نهایت پکها با هم ترکیب میشوند، ساخته میشوند، سلولهای بزرگ LFP میتوانند به طور مستقیم به طور مستقیم طراحی شوند. ارائه دهنده. این استراتژی تحت عنوان سلول تا پک (C2P) شناخته میشود. این اتفاق مطمئناً برای چگالی انرژی ناقص LFP اثر مثبت دارد، اما با انجام محاسبات متوجه میشویم که این استراتژی، هرگز برای مصرف انرژی چگالی به اندازهای چگالی انرژی کاتدی با مقدار نی زیاد با استوکیومتری 811 کافی نیست.
ساختار بلوری آند
بعد از گذشت 30 سال از ساخت باتری تجاری یون-لیتی، هنوز از مواد آندی کربنی که در ابتدا توسط یوشینو ارائه شد، استفاده می شود. در شکل ۲، ساختار بلوری مواد آندی بعد از لیتیومدار شدن، (در حالت شارژ) ارائه شده است باید در نظر داشته باشد از مواد کاتدی، مواد آندی به صورت ذاتی در خود لیتیوم ندارند.
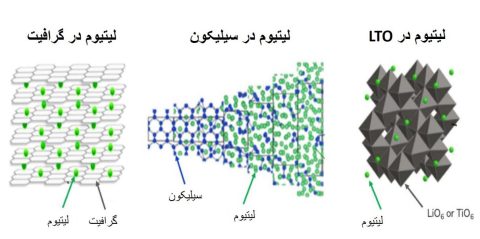
شکل2: ساختار مواد آندی
آندهای گرافیتی (کربنی)
در اولین باتری یون- لیتیوم تجاری شده، از کُک به دست آمده از نفت، به عنوان مواد آندی استفاده میشود و در نهایت با گرافیت جایگزین میشود که تا همین الان هم مادهای آندی مورد استفاده است، مواد گرافیتی لایهای هستند. این مواد دارای ساختار ورقههای مانند صفحات تکی گرافن، با طراحی بدون پایان هگزاگونالی از کربن میباشند. درجههای که کل ماده با این ساختار منظم روی هم قرار گرفتهاند را درجهی بلورینگی یا گرافیتی میگویند. روش قرار گرفتن یونهای لیتیوم در داخل گرافیت، نگه داشتن در بین صفحات است، اما نه مثل مواد کاتدی دو بعدی که قبلاً گفته شده است. هر حلقهای تشکیل شده توسط شش اتم کربن، حداکثر میتواند یک یون لیتیوم باشد.
انواع مختلفی از مواد گرافیتی وجود دارد، اما همهی آنها دو به دو به صورت طبیعی یا مصنوعی به دست میآیند. در حالت طبیعی، گرافیت به صورت پوسته پوسته از طبیعت استخراج میشود و در حالت مصنوعی از مواد نفتی تولید میشود. فرآیند مصنوعی تولید گرافیت، نیاز به دمای خیلی بالایی دارد، به همین دلیل یک فرآیند متمرکز بر انرژی است. در حالیکه گرافیت طبیعی، نیاز به خالص سازی، توسط مادهای مانند اسید سولفوریک دارد. با وجود این موضوعات، نکتهی قابل توجه در مورد گرافیت این است که ورود یون لیتیوم به داخل ساختار با طول عمر چرخهی بالا بسیار برگشتپذیر است. گرافیت به دلیل پایداری مکانیکی بالایی که دارد، تغییر حجم کمی را در طی شارژ و دشارژ تجربه میکند. پتانسیل الکتروشیمیایی گرافیت، نزدیک به پتانسیل شیمیایی لیتیوم خالص است، که این موضوع به حداکثر رساندن چگالی انرژی کمک میکند، علاوه بر این موضوعات، گرافیت ظرفیت بالایی نیز دارد.
مدتی است که پیشرفت در باتریهای بر پایهی Li، مبتنی بر جایگزینی گرافیت با مواد آندی دیگر است. این تلاشها با سنتز سیلیکون و لیتیوم خالص به عنوان آند در حال انجام است، اما هیچکدام از این مواد آندی جدید، به جایگزینی با گرافیت، حتی نزدیک هم نشدهاند. گرافیت علیرغم ایراداتی که دارد یک مادهی آندی عالی است.
آند برپایه سیلیکون
در حالیکه شش اتم کربن میتوانند میزبان یک اتم لیتیوم باشند، یک اتم Si با چهار یون لیتیوم پیوند مییابد. به همین دلیل به سادگی میتوان دریافت که سیلیکون دارای ظرفیت بالایی در مقایسه گرافیت است. این همان بخش جذاب است که بسیاری از مردم مدتهاست به دنبال آن هستند. البته با موفقیت کم.؟!!!
برخلاف گرافیت و یا مواد کاتدیی که قبلاً بررسی کردیم، مکانیسم عمل سیلیکون، جای دادن یون لیتیوم در داخل ساختار خود نیست. سیلیکون به اصطلاح با لیتیوم خیلی صمیمی و خودمانی میشود و به صورت برگشتپذیر یک آلیاژ تولید میکند. درست همانطور که قبلاً در مورد فویل آلومینیوم یاد گرفتیم، مواد آلیاژی منجر به تغییر حجم فوقالعادهای میشوند. بنابراین، در حالیکه سیلیکون در هرگرم، بیش از ده برابر گرافیت ظرفیت دارد، تقریباً ۳۰۰% نیز تغییر حجم هم دارد. این انبساط حجمی ریشهی اکثر مشکلات مربوط به سیلیکون است. یک مشکل سادهای که هرکسی میتواند آن را درک کند، اما در واقع یکی از سختترین مشکلات برای حل است.
تغییر حجم شدید سیلیکون موجب میشود، که لایهی SEI تشکیل شده، در هر بار شارژ/دشارژ تخریب شود. این موجب میشود که سطح بیشتری برای ایجاد لایهی SEI ایجاد شود. بعد از اعمال چرخههای شارژ دشارژ زیاد، ذرات سیلیکون در نهایت به پودر و قطعات کوچک تبدیل میشوند، که سطح جدیدی را برای دوباره پوشانده شدن نشان میدهند. هر بار که لایهی SEI تشکیل میشود، لیتیوم به طور برگشتناپذیری مصرف میشود و این موضوع باعث از بین رفتن سریع ظرفیت میشود. علاوه بر این مواد فعال سیلیکونی که تبدیل به پودر شدهاند، از شبکهی CBD خارج شده و از نظر الکتریکی ایزوله میشوند. سیلیکونی که به صورت الکتریکی ایزوله شده است توانایی خود را در ذخیرهی ظرفیت از دست میدهد. چون در این حالت، الکترونها راهی برای دسترسی به ذرات ندارند و هیچ لیتیومی نمیتواند وارد و خارج بشود.
با این حال، وعدهی ده برابر ظرفیت نسبت به گرافیت، دلیل کافیای برای پیدا کردن راه حلی برای حل مشکلِ تغییر حجم سیلیکون است. استراتژیهای کلیدی زیادی مانند ساخت پودر با ذرات بسیار کوچک برای مقاومتِ بهتر در برابر پودر شدن، استفاده از ترکیبات جدید مانند اکسیدهای سیلیکونی و یا قرار دادن ذرات سیلیکون در داخل قفسهای کربنی برای جلوگیری از تغییر حجم و تخریب بیشتر تا به الآن ارائه شده است. در ابتدا؛ رویا استفاده از سیلیکون خالص به عنوان آند بود، اما حالا این هدف به آندهای با مقدار غالب سیلیکون تغییر کرده است. با این وجود، باز هم جایگزینی آند گرافیتی کار دشواری است.
امروزه در بسیاری از باتریهای یون-لیتیوم تجاری، مقادیر کمی از سیلیکون( معمولاً کمتر از ۷ الی ۱۰%) را عمدتاً با گرافیت ترکیب میکنند و به عنوان آند استفاده میکنند. این استراتژی موجب افزایش چگالی انرژی بدون ایجاد خلل در عمر چرخه میشود ( البته مطمئناً عمر چرخهای را، هرچند به میزان کم، دچار اختلال میکند).
آند لیتیم تیتانات
دستهی پایانی، نوعی از مواد آندی است که همیشه برای کاربردهای خاص در حاشیه است و احتمالاً هرگز از این حاشیهها جدا نشود. آندهای LTO دارای ساختار اسپینلی هستند. این مواد آندی به دلیل حضور اکسیژن و لیتیوم در ساختار آنها، گاهی اوقات ممکن است با مادهی کاتدی اشتباه گرفته شوند. اما بر خلاف مواد کاتدی، LTO با جذب یون لیتیوم کار میکند، بنابراین به عنوان یک آند استفاده میشود. مادهی آندی LTO، شبیه به مادهی کاتدی LMO دارای ساختاری سه بُعدی است، این به این معنی است که LTO در مقایسه با گرافیت که دارای ساختا دو بُعدی است، سرعت بالاتری دارد. بنابراین آندهای LTO میتوانند خیلی سریعتر شارژ/ دشارژ شوند. آندهای LTO از سرنوشتی مشابه به LFP رنج میبرند، یعنی ظرفیت پایین دارند (تقریباً نصف گرافیت) و پتانسیل الکتروشیمیایی بالایی دارند. از آنجا که ولتاژ هر باتری یون-لیتیوم، تفاوت بین ولتاژ کاتد ( همیشه بالاتر) و ولتاژ آند ( همیشه کمتر) است، پتانسیل بالای آند موجب کاهش ولتاژ کلی سلول کامل میشود. در نتیجه سلولهای حاوی آند LTO به طور قابل توجهی چگالی انرژی پایینی دارند. این آندها اگر با کاتد LFP جفت شوند یک ضربهی وحشتناک را به چگالی انرژی سل وارد میکنند، البته این جفت شدن کاملاً غیر عملی است.
با این حال پتانسیل الکتروشیمیایی بالای LTO دو نکتهی جالب دارد: 1- در LTO لایهی SEI تشکیل نمیشود، چون LTO در ولتاژهای بالا کمتر با الکترولیت وارد واکنش میشود. 2- چون که در ولتاژهای کاربردی LTO، لیتیوم با آلومینیوم آلیاژ نمیشود، میتوان از فویل آلومینیوم به عنوان جمع کنندهی جریان LTO استفاده کرد. استفاده از فویل آلومینیوم به عنوان جمع کنندهی جریان آند میتواند موجب کاهش وزن سلول شود، اما این موضوع تمام مشکلات مربوط به چگالی انرژی را جبران نمیکند. به همین دلیل، LTO فقط برای موارد خاصی که به سرعت شارژ دشارژ بالا نیاز است مورد استفاده قرار میگیرد.
ترکیب الکترولیت
جزء نهایی مورد بررسی، الکترولیت است. الکترولیت آخرین مادهای است که به سلول تزریق میشود. الکترولیتها شبیه به مادر برای باتریهای یون لیتیوم هستند. الکترولیتها باید در پنجرهی پتانسیل اعمالی پایدار باشند، کاتد و آند را تحمل کنند. باید این اطمینان توسط الکترولیتها حاصل شود که همه چیز با هم در ارتباط هستند. الکترولیتها تنها جزئی هستند که تمام اجزای دیگر را لمس میکنند.
به منظور تعیین تقریبی تمام نیازهای موجود از الکترولیت، فرمولاسیون الکترولیت در نهایت به ترکیبی از چند جزء متفاوت است که هر جزء برای محاسبه و بهبود یکی از آن نیازها ارائه می شود. هر یک از این اجزای الزامی و دیگر اختیاری هستند:
نمک لیتیومی ( الزامی): مادهای که توسط حلال الکترولیت حل میشود (مانند نمک در آب) و یونهای لیتیوم را در محلول الکترولیت میکند. مقدار بیشتری از این نمک را افزایش می دهد. زیرا لیتیوم موجود در نمک به صورت یون مثبت وجود دارد و الکترونی برای همراهی آنها وجود ندارد. فقط لیتیومهای ذخیره شده در مواد فعال دارای الکترونهایی برای کمک به استفاده از الکتریسیته هستند، به همین دلیل قدرت سل فقط به مقدار این لیتیومها دارد. یونهای منفی نمک لیتیومی (معمولاً LiPF ۶ – ) معمولاً بی هدف شناور میمانند، اما گاهی اوقات برای ایجاد لایههای غیرفعال بر روی فویل غیرقابل استفاده میشوند. افزایش غلظت و افزایش میزان نمک لیتیومی مورد استفاده میتواند رسانایی را تا یک نقطهی خاص افزایش دهد، اما بعد از آن موجب کاهش رسانایی میشود ( در غلظتهای خیلی بالا، هدایت دوباره افزایش مییابد). باعث افزایش ویسکوزیته می شود که مطلوب نیست.
حلال (الزامی): حلال برای حل و تفکیک کاتیونها از آنیونها مورد نیاز هستند. حلال باید وجود داشته باشد تا در تمام اجزای کند و منافذ را بر کند. همچنین حلالها اجزای کلیدیای در تشکیل لایههای SEI و CEI هستند. حلالها معمولاً ترکیبی از مولکولهای مختلف آلی و مولکولهای علی بر پایه کربناتها هستند.
افزودنیها ( این مورد اختیاری است، اما استفاده نمیشود از آن اشتباه است): افزودنیها میتوانند هر چیزی باشند که مقدار آنها کمتر از 5% باشد. افزودنیها میتوانند نمک و یا مولکولهای حلال باشند. این افزودنیها برای رفع مشکلاتی مانند بهبود کیفیت لایههای SEI، افزایشدهندهها برای افزایش تر شدن یا سایر موارد مختلف است که برای بهبود عملکرد عملکرد پایدار، عملکرد سلول در پایین، شارژ سریع، افزایش ایمنی و... استفاده میشود. از آن جا که موادی در کممورد استفاده میشوند، میگیرند و در مواردی که میگیرند، در اولین چرخش شارژ، واکنش برگشتپذیر از خود نشان میدهند، به همین دلیل این مواد سخت را معکوس میکنند. به همین دلیل از سلولهای تجاری، دستورالعملهای بسیار محرمانهای دارند.
حلال های کمکی (اختیاری): حلال های کمکی باعث کاهش ویسکوزیته شدن الکترولیت می شود که این امر باعث بهبود عملکرد و بهبود رفتار خیس می شود.
اکنون که کلیه مکانیسمها و مواد موجود در باتریها را شناختیم شکل ۳، برای ما راحت است. تصویر 2، مکانیسمها و اتفاقاتی را نشان میدهد که میتواند باعث کاهش و خراب شدن شود و میتوان این باتریها را پیچیده کرد.

شکل ۳: مکانیسمها و اتفاقات کلی داخل باتری
باتریهای یون لیتیوم علیرغم کاستیهایی که دارند، بدون شک تا مدتزمان استفاده خواهند کرد. احتمالاً حداقل برای ده الی پانزده سال آینده، به عنوان فناوری روز، به ویژه برای خودروهای الکتریکی باقی خواهند ماند.
0 نظر
نظر بدهید